SIFAT KOLIGATIF LARUTAN Bagian Ke-1 - Mudah dan Cepat Dipahami
SIFAT KOLIGATIF LARUTAN
(Bagian Ke-1 - Pengantar)
A.
Satuan Konsentrasi:
- Molalitas (simbol: m)
- Molaritas (simbol: M)
- Fraksi mol (simbol: x)
B.
Pengertian:
1. 1. Molalitas (m) adalah
jumlah mol zat terlarut dalam 1.000 gram pelarut.
Rumus:

Keterangan:
m = simbol
satuan molalitas
n = mol
zat terlarut (dalam mol)
p = massa
zat pelarut (dalam g)
g = massa zat terlarut (dalam g)
Mr = massa molekul relatif (dalam g/mol)
1.
2. Molaritas (M) adalah
jumlah mol zat terlarut dalam 1 Liter larutan.
Rumus:

Keterangan:
M = simbol
satuan Molaritas
n = mol
zat terlarut (dalam mol)
V = volume
larutan (dalam L)
g = massa
zat terlarut (dalam g)
Mr =
massa molekul relatif (dalam g/mol)
1.
3. a. Fraksi mol (molfraksi)
adalah perbandingan antara jumlah mol suatu komponen dengan jumlah total
seluruh komponen dalam suatu larutan.
b. Fraksi mol (molfraksi)
adalah perbandingan mol suatu zat dengan jumlah mol campuran.
Misal:
a mol zat p dicampurkan dengan b mol zat q, maka:
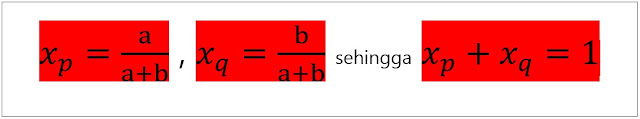
Rumus:

Keterangan:
xt = fraksi mol zat terlarut
xp = fraksi mol zat pelarut
nt =
mol zat terlarut
np =
mol zat pelarut
nt+np = total mol larutan
Catatan: -fraksi mol (molfraksi) tidak memiliki satuan
-dalam suatu larutan atau
campuran, total fraksi mol (molfraksi) sama dengan 1
C. Contoh Soal:
1.
1. Contoh Soal molalitas
(m)
I.
Apa arti larutan HCl
0,1 m?
Penyelesaian:
Larutan
HCl 0,1 m yaitu larutan yang terdiri dari 0,1 mol HCl dalam setiap 1.000 g
pelarut (air).
II.
Tentukan molalitas
dari 15 gram urea (Mr = 60) yang dilarutkan dalam 500 gram air!
Penyelesaian:
Diketahui:
massa urea = 15 g
Mr
urea = 60 g/mol
p
air = 500 g
Ditanya: m larutan urea = ?
Jawab:

III.
Sebanyak 0,2 molal
larutan glukosa (Mr = 180) terlarut dalam 100 gram air. Tentukan massa glukosa!
Penyelesaian:
Diketahui: molalitas larutan glukosa = 0,2 m
Mr
glukosa = 180 g/mol
p
air = 100 g
Ditanya: massa glukosa = ?
Jawab:

1.
2. Contoh Soal
Molaritas (M)
I.
Apa arti larutan HCl
0,1 M?
Penyelesaian:
Larutan
HCl 0,1 M yaitu larutan yang terdiri dari 0,1 mol HCl dalam setiap 1 L larutan.
II.
Sebanyak 0,1 M
larutan asam sulfat dilarutkan dalam air sehingga volumenya menjadi 200 ml.
Tentukan jumlah mol larutan!
Penyelesaian:
Diketahui: M larutan asam sulfat = 0,1 M
V
larutan asam sulfat = 200 mL = 0,2 L
Ditanya: n larutan asam sulfat = ?
Jawab:

III.
Sebanyak 0,25 M
larutan sukrosa (Mr = 342) dilarutkan dalam air dengan massa 34,2 gram.
Tentukan volume larutan!
Penyelesaian:
Diketahui: M larutan sukrosa = 0,25 M
Mr
larutan sukrosa = 342 g/mol
massa
larutan sukrosa = 34,2 g
Ditanya: V larutan sukrosa = ?
Jawab:

1.
3. Contoh Soal Fraksi
mol (x)
I.
Sebanyak 30 gram
urea (Mr = 60) dilarutkan dalam 90 gram air (Mr = 18). Tentukan fraksi mol
masing-masing zat!
Penyelesaian:
Diketahui: massa urea = 30 g
Mr
urea = 60 g/mol
massa
air = 90 g
Mr
air = 18 g/mol
Ditanya: xt
dan xp = ?
Jawab:



